例:H2を構成式で表すと...
H - H
と、なる。因みにこのH同士を結ぶ線が価標である。 アンモニア(NH3)ならば
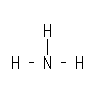
と、なる。
この価標の数は物質によって決まっていて、例えば、
C(炭素)なら4本、H(水素)なら1本、O(酸素)なら2本、N(窒素)なら3本である。
これを知っておくと化学式を書くときに役立つ...かもしれない。
| アボガドロの法則 |
| あらゆる気体は、同温度、同圧ならば同体積中に 同数の分子を含むという法則。 |
| アルカリ金属 |
| H(水素)を除く1族の元素の総称。 |
| アルカリ土類金属 |
| Be(ベリリウム),Mg(マグネシウム)を除く2族の元素の総称。 |
| イオン |
| 原子や分子が、電子を受け取って電荷を持った物の事。 イオンには陽イオンと陰イオンの2つがあります。 陽イオン ~ 原子が電子を失って、全体として+の電気をおびたもの。 陰イオン ~ 原子が電子をもらって、全体として-の電気をおびたもの。 |
| イオン化エネルギー |
| 原子が電子1個を放出するのに必要なエネルギー。 |
| 化学式 |
| O2、
H2Oなど元素記号と数字を用いて表した式。 |
| 化学反応式 |
| 化学反応を化学式を用いて表した式。 例:C+O2→CO2 |
| 価標 |
| 構造式で分子中の原子の繋がりを表した線。 |
| 希ガス |
| He(ヘリウム),Ne(ネオン),Ar(アルゴン),Kr(クリプトン),Xe(キセノン),Rn(ラドン)の18族元素の事。 |
| 気体反応の法則 |
| 2種類以上の気体が反応する場合、その反応で生成または消費した各気体の体積には 同じ圧力、同じ温度のもとで簡単な整数比が成り立つという法則。 ゲーリュサックによって発見された。 |
| 共有結合 |
| 原子同士で互いの電子を共有することによって生じる非常に強い化学結合。 |
| 原子 |
| 物質の最小構成単位。これを複数組み合わせると分子となる。 原子核と電子によって構成されている。 紀元前にギリシアの哲学者デモクリトスによって唱えられたが、 確立したのは19世紀頃になってからである。 |
| 元素 |
| 原子に含まれる陽子の数(原子番号)で原子を分類したもの。化学物質を構成する基礎となる成分。 周期表で表される。 因みにH(水素)が一番最初である。 |
| 元素記号 |
| 原子や元素を表す記号。化学式や化学反応式等を表すのに使われる。 1814年にベルセーリウスによって考案されたが、現在も変わらず使われている。 |
| 構造式 |
| 価標を用いて分子の構成を図で表した物。 例:H2を構成式で表すと... H - H と、なる。因みにこのH同士を結ぶ線が価標である。 アンモニア(NH3)ならば  と、なる。 この価標の数は物質によって決まっていて、例えば、 C(炭素)なら4本、H(水素)なら1本、O(酸素)なら2本、N(窒素)なら3本である。 これを知っておくと化学式を書くときに役立つ...かもしれない。 |
| 酸・塩基の定義 |
| 物質を酸あるいは塩基に分類する方法。 分類する方法は現在では3種類存在する。 ①ブレンステッド・ローリーの定義 酸は他の物質と化合する時にH+(水素イオン)を与える物質である。 塩基は酸とは逆にH+を受け取る物質である。 ②アレニウスの定義 酸は水に溶けてH+を生成する物質である。 塩基は水に溶けてOH-(水酸化物イオン)を生成する物質である。 ③ルイスの定義 酸は電子を受け取る物質である。 塩基は電子を与える物質である。 因みに、酸と塩基が化合して起こる反応が中和である。 酸と塩基は電離度の違いで強酸・弱酸、強塩基・弱塩基に分けられる。 |
| 質量保存の法則 |
| 化学反応の前後で関わった元素の種類とそれぞれの量は変わらないという法則。 ラボアジエによって発見された。 |
| 水素イオン濃度 |
| 物質の酸性、アルカリ性の度合いを表す物。 記号pHで表される。pH=7が基準(中性)である。 7より小さければ酸性、大きければアルカリ性である。 |
| 水素結合 |
|
水素を含む分子同士が静電気力(クーロン力)で引き合う事。 要するに分子間力(ファンデルワールス力)の特殊な形。 因みに水やアンモニアなどの物質の沸点が高いのは水素結合で化合してるため。 |
| 族・周期 |
|
周期表を表すための物。 周期表の縦の列が族、横の列が周期である。 これによって元素の様々な分類が可能になった。 |
| 中和 |
|
酸と塩基が交わって塩と水を生成すること。 因みに塩(えん)とは酸と塩基の化合によって発生した水以外の物質のことを指す。 |
| 定比例の法則 |
| 物質が化合する際、その質量比は常に一定だという法則。 |
| 電解質 |
|
水に溶けて電離する物質の事。
また、水に溶けても分離しない物質を非電解質という。 |
| 電子親和力 |
| 原子が電子を1つ受け取って1価の陰イオンになるときに発生するエネルギーの事。 |
| 電離式 |
|
電離とは物質が陽、陰イオンに分かれる反応の事を指す。 つまり電離式とは、その反応をイオン式を用いて文字で表したもの。 |
| 電子配置 |
|
原子の中に含まれる電子を図で表したもの。 円を何個か描き、内側からK、L、M、N殻となっている。 K殻には2個、それ以外の殻には8個まで電子が入れられる。 例:炭素の電子配置 炭素の電子数は6なので 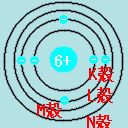
|
| 同位体 |
|
原子番号が等しく、かつ質量数が異なっている原子の事。
アイソトープとも言う。 例えば、水素にも質量数が1と、2のものがある。 |
| 同素体 |
|
同じ元素で同じ単体だが、性質の異なる物質の事。 例えば、炭素にはダイヤモンド、黒鉛、フラーレン等の種類が存在する。 |
| 濃度 |
|
混合物において1つの成分が全体を占める割合の事。 モル濃度の場合は物質量とも言う。 |
| 熱化学方程式 |
|
化学変化に伴って出入りする熱量を数字化して反応式に含めた式。
熱量は記号「J」(ジュール)で表す。 |
| 燃焼 |
|
発熱を伴う化学変化。また、酸素と化合する化学変化の事も指す。 |
| 倍数比例の法則 |
|
「2つの元素が化合する場合、それぞれの元素の質量は簡単な整数比で表せる」 という法則。 例:水素と酸素の反応 2H2+O2→2H 2O 水素の原子量は1、酸素は16なので、 比は2:16、すなわち1:8となる。 |
| 配位結合 |
|
結合を構成する2つの原子の一方からのみ電子が移る結合。 |
| ハロゲン |
|
第17族元素の総称。 フッ素・塩素・臭素・ヨウ素・アスタチンがこれにあたる。 |
| 非電解質 |
|
水溶液に電流が流れない物質。 また、水に溶けてもイオンにならない。 |
| 分子 |
|
共有結合した、あるいは原子が単独で存在する原子の塊。 また水素、窒素、酸素などの分子は同じ原子が2個集まって構成している二原子分子である。 例えば水素を表記するとH2と、なる。 分子の概念はアボガドロによって発見された。 |
| 放射性同位体 |
|
構造が不安定で、時間と共に崩壊していく同位体の事。 別名、ラジオアイソトープとも呼ばれる。 |
| 沸点・融点 |
|
沸点…物質が沸騰し始める温度。 融点…固体が融解して液体になる温度。 |
| モル |
|
物質量の単位。 具体的に記述すると、12グラムの炭素の中に存在する原子数と等しい構成要素を含む物質量。 物質量の基準の量は6.02×1023個だが、 気体では22.4リットルである。 |
| モル質量 |
|
物質1molの質量。 例えば、水素のモル質量は1、炭素は12、酸素なら16である。 当然、物質によって決まっている。 |
| モル濃度 |
|
文字通りその物質のモルの濃度を表す。 式は  である。 |
| 溶解度 |
|
ある物質が一定量の溶媒に溶ける限界量の事。 これに達した水溶液は、飽和水溶液と呼ばれる。 |
| 溶質・溶媒・溶液 |
|
溶質…溶媒にならない固体、液体、気体などの成分。物質のほとんどがこれである。 溶媒…物質の混合において主要となる液体成分。水などがこれにあたる。 溶液…2つ以上の物質で構成されている混合液。 主に溶質と溶媒で構成される。 |
| ラジオアイソトープ |
|
放射性同位体の別名。 |
| mol |
|
物質量を表す「モル」の単位。 |
| pH |
|
水素イオン濃度を表す記号。 |
| 6.02×1023 |
|
物質1molを構成する粒子(イオンとか)の総量。 アボガドロ定数とも呼ばれている。 基準は炭素(物質量12g)である。 6.0221415×1023が最も正確な基準とされている。 |