4−1 高校化学の導入
ここでは中学生向けに高校化学の基礎の基礎を非常に簡単に(「解り易く」ではなく「簡単に」)解説する。高校生以上の人なら飛ばしても構わないだろう。4−3のラボアジェの紹介へ。
なお、高校では赤文字で書いてあることはほとんど暗記すべき事項である。
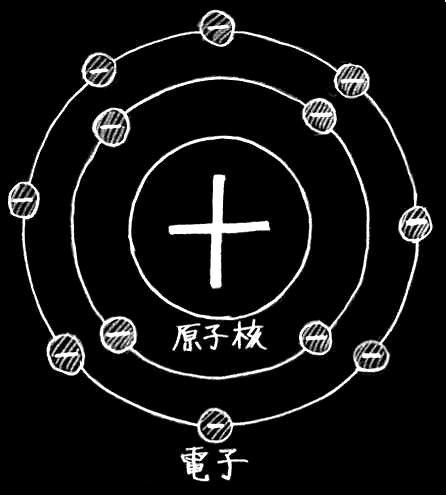
まず、世の中の物質は全て原子からできている。原子は陽子、中性子から成り立つ原子核とその周りを回る電子から成り立ち(右図参照)、それらの組み合わせの違いから現在約118種発見されている。基本的に陽子の数で原子は区別され、陽子の個数は原子番号と等しい。
つまり、二つの物質で陽子の個数が違うならそれらは別の物質という事である(中性子については後述)。なお、電子の個数は増減し、電子の個数が通常と違う状態をイオンという(これも詳しくは後述)。
また、それらの原子は陽子と中性子の数から質量が求められる。陽子を中性子は質量がほとんど同じなので、「陽子の個数+中性子の個数=原子の質量」となり、原子の質量のことを質量数という。。と言っても、原子は非常に小さく、実際に重さを測れる訳ではないので他の原子と重さを比べるための概念的な重さであり、単位はつかない。
また、同一の元素で質量の違うものも存在する。それらは同位体と言って定義では「原子番号が同じで質量数が異なる原子」となり、化学的性質はほとんど変わらない。
次に電子だが、通常電子は陽子と同じ数だけ存在するが、質量は陽子の質量の1840分の1という小さい値のため、元素の質量には考慮しない。電子は、原子核を太陽とすると太陽系の惑星のように原子核の周りを回っている。電子と惑星の違いは、電子の方は同一軌道上に複数個存在するということである。また、この電子の動く部分を電子殻という。
電子殻は一つではなく原子核の周囲に複数存在し、一番原子核に近いものから K殻、L殻、M殻…と呼ばれ、収容できる電子の数がだんだん増えていく。K=1番目、L=2番目、M=3番目…とした場合、N番目の電子殻の収容できる電子の数は 2N^2 ( N の二乗の二倍)となる。
では、上記の事を酸素原子を例に説明する。酸素は質量数16、原子番号8、元素記号Oであり、以下のように表記される。
なお、電子は通常表記されない。
(元素記号については後述)
つまり「全ての物質は原子から成り立っている」「全ての原子は陽子中性子電子から成り立っている」という事から、「全ての物質は陽子中性子電子の三物質から成り立っている」とも言える。
次に元素について解説する。元素とは原子と意味合いが似通っており分かり難いが、要は「原子の種類を表す名称」である。原子とは「その物質のそれ以上分割不能な最小の単位、構造面」(実際に最小の単位ではない)を指し、元素は「その物質の構成要素や成分、性質面」を指す。この違いは重要なので混乱しないようにしたい。
これらの元素を、原子番号順に並べたものを周期律といい、周期律に従って全元素を一覧表にしたものを周期表と呼ぶ。周期表は こちら (別窓で開きます)。
この周期表上において、横の並びである族によって特別な呼び方のある族がある。第1族を「アルカリ金属」、第2族を「アルカリ土類金属」、第17族を「ハロゲン」、第18族を「希ガス」という。
多くの人はCO2やH2O等の単語を目にしたことがあるだろう。これらは化学式と言って、その物質を構成する元素記号で表す表記法である。
例えばCO2は二酸化炭素の事だが、Cが炭素の元素記号、Oが酸素の元素記号なので、CO2は炭素原子二つと酸素原子一つから成り立っているという事である。つまり「空気中に存在する元素記号がOの酸素という元素は、質量数16原子番号8の原子である。」と言える。
更に複雑な事に、酸素は空気中ではO2として、つまり酸素原子が二つくっついて存在しているため、化学では通常O2と表す。この様に、二つ以上の原子がくっ付いているものを 分子 という。
ところで、この概念、錬金術における物質の原一性と非常に酷似していないだろうか。また、三つの要素という点から三原質との類似点も見られる。
次のページでは、このページで学習したことを踏まえ、もう少し踏み込んだ内容をやる。
<前講 トップへ 次ページ>
