DNAチップ
DNAの相補性を利用して以前より簡単に遺伝子の発現の具合を調べる技術です。
実際に細胞内で働いているmRNAを一度、かつ短時間に調べることができます。
今までは、どのように遺伝子が発現されているかを調べるだけでも多大な時間を費やしていました。
ですが、この技術によって、全遺伝子をたった一枚のスライドガラスやシリコン基盤で調べられます。
どのような仕組みなのでしょうか?
現在使われているDNAチップには
・アメリカのアフィメトリックス社が確立させた「GeneChip(ジーンチップ)」
・スタンフォード大学が携わった「スポット型アレイ法」
二つの手法があります。
ここでは、スポット型アレイ法について説明します。
この手法には、二つの準備が必要です。
基盤の準備
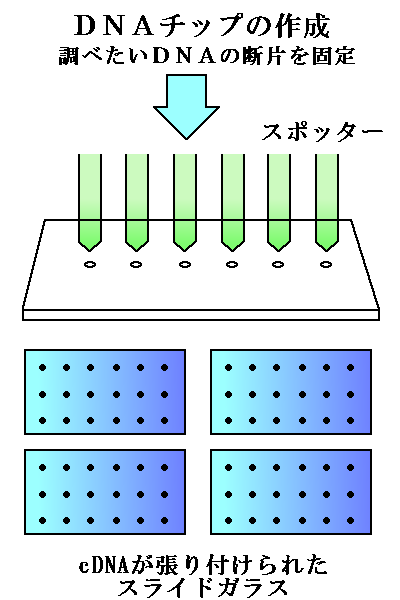
一つは基盤の用意です。
スライドガラス上に、cDNAを貼り付けていきます。
cDNAとは、mRNAの相補的な配列になっているDNAで、mRNAに結びつくことができます。
逆転写酵素*を利用してmRNAからcDNAを作ります。
cDNAと調べたいmRNAが結びつく、ということがこのプロセスの鍵となります。
 (ただ最近は、cDNAを用意して貼り付ける方法よりも、人の手でデザインされたオリゴヌクレオチドを使うタイプが主流となっています。
(ただ最近は、cDNAを用意して貼り付ける方法よりも、人の手でデザインされたオリゴヌクレオチドを使うタイプが主流となっています。
調べたいことに合わせて自由に設定できるので、より詳細なデータを得ることができるためです。)
用意したcDNAをスライドガラスに貼り付けていくわけですが、遺伝子の数、つまり数万個ほどの種類を貼り付けていくことになります。
これは、到底人間の手で出来るような作業ではありません。
そこでスポッターという機械が活躍します。
ピンの先にcDNAを固定し、それをスライドガラスに押しつけることで貼り付けていきます。
この配置する技術には、インクジェットプリンターのように吹き付けることで一度にセットする「インクジェット方式」、スポッターを加熱してつくった泡の圧力で噴出する「バブルジェット方式」などもあり、今現在、研究が進められています。
細胞の準備
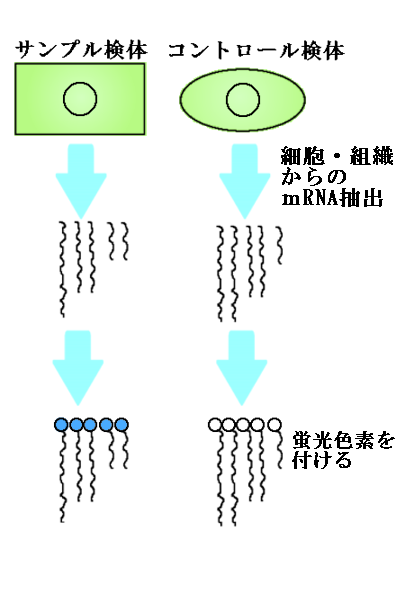
もう一つの準備は細胞の準備です。
まずは調べたい細胞を用意します。この細胞を「サンプル検体」といいます。
また、その細胞とは別に、普通に育てられた細胞も用意します。こちらは「コントロール検体」といいます。
サンプル検体側の遺伝子がどのように変化しているかを比較する基準として、コントロール検体を用意するのです。
これら二つの細胞は、それぞれ違ったmRNAを作っています。
 mRNAの状態とはつまり、”どういった”遺伝子が”どの程度”発現しているか、という指標になります。
mRNAの状態とはつまり、”どういった”遺伝子が”どの程度”発現しているか、という指標になります。
例えば、サンプル検体側ではあるタンパク質のmRNAが2本あり、コントロール検体側では1本しかないとなると、サンプル検体はその遺伝子をより強く発現させていることが予想されます。
もちろん、一つの細胞についてだけを調べて、他のデータと照らし合わせることも可能です。
二つの細胞からmRNAを取り出し、それぞれのmRNAに違った色の蛍光色素を塗りつけておきます。
一般的には、赤色のCy5と、緑色のCy3という蛍光色素が使われます。
ここではサンプル検体に赤色を、コントロール検体に緑色のものを使ったとしましょう。
ハイブリダイゼーション
両方の準備が出来たら、mRNAとスライドガラスを反応させます。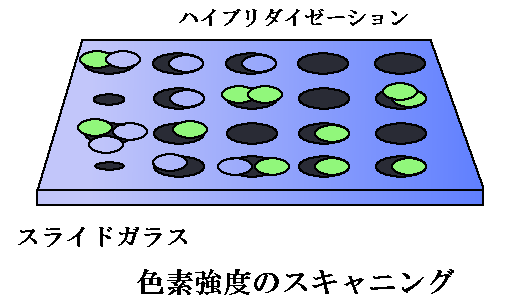
相補的な配列になっているため、貼り付けられたcDNAと細胞内にあったmRNAが結びつきます。
あらかじめ貼り付けたcDNAの種類と場所はわかっているので、結びついた量でmRNAの量を照らし合わせると、遺伝子の発現具合がわかります。
結びついた量は、蛍光色素の色合いを機械でスキャンすることで判断します。
多くの量のmRNAが結びついていると、それだけ強い色として出るからです。
ここでは、赤が強ければサンプル検体側が、緑が強ければコントロール検体側が、混ざった黄が出れば両方のmRNAがあることがわかります。
最終的には色の強さでサンプル検体とコントロール検体のmRNAの量を比較し、サンプル検体で異常になっている遺伝子がわかるというわけです。
(この例では蛍光色素を用いましたが、非伝導性物質とを結び付けて、導電性を計測する方法もあります。低コストで素早い検査のための研究が行われています。)
こうして、スライドガラスと細胞があれば手早く遺伝子の状態がわかりました。
この技術が進めば、より遺伝子検査が私たちの身近なものになることが予想されます。
Design by

